Allenamento e salute è l’inscindibile ed indiscusso connubio conosciuto e consolidato ormai da eoni in seno al sapere della collettività ed è anche uno dei validi motivi per il quale la maggior parte delle persone si avvicina alla pratica dell’esercizio fisico nelle sue diverse e variegate forme.
Tuttavia, il presente articolo in origine non riportava il titolo “allenamento e salute” ma uno un po’ più specialistico rispetto al tema trattato e che ha costituito e rappresentato per il sottoscritto motivo di tesi per il master di secondo livello in: STRESS, SPORT, NUTRIZIONE: NUOVI APPROCCI DIAGNOSTICI E TERAPEUTICI PER WELLNESS, FITNESS, PREVENZIONE E RIABILITAZIONE”, facoltà di farmacia e medicina, Sapienza, Università di Roma.
Il suo titolo originario è, dunque:
Miglioramento della longevità e dei processi cognitivi su mediazione delle risposte adattative endocrino-metaboliche e dei pattern di segnalazione cellulare responsabili dei processi ipertrofici evocati dall’allenamento di resistenza coi pesi.
Il titolo, in questa sede, è stato riadattato per la versione web al fine di favorire – da parte del web navigante – una più agevole, facile ed immediata contestualizzazione, a grandi linee, del tema ed oggetto trattati attraverso l’utilizzo di tre comuni e semplici parole (allenamento e salute) che senza indugio rimandano prontamente al senso del contenuto che segue.
Come si vedrà, tuttavia, la generica parola “allenamento” sminuisce e svilisce le complesse e profonde vicende organiche giovevoli alla salute del singolo che si ergono prevalentemente in risposta ad alcune e precise prerogative di intensità dell’allenamento stesso.
MITI E FALSA INFORMAZIONE
Come vuole il mito, l’ignoranza diffusa e altresì l’assai poca diffusa nozione scientifica relativa agli adattamenti metabolici, ormonali ed immunitari derivanti da uno stile di vita corretto come quello del bodybuilder e che giustifica la longevità dello stesso, il bodybuilding ancora oggi – per i molti non addetti al settore e per la massa – è considerato appannaggio di una minoranza caratterizzata da megalomanie, spasmodica ricerca di vigore fisico ai fini narcisistici o, ancora, uno strumento per sviluppare imponenti adattamenti fisici atti a celare le proprie insicurezze personali o, ancora, il motivo per l’instaurarsi di raccapriccianti condizioni psicopatologiche come la dismorfia muscolare (anche conosciuta sotto altri appellativi, quali: bigorexia, anoressia inversa, vigoressia) indirizzata alla spasmodica ricerca di condizioni ipermesomorifiche o ipertrofiche fini a sé stesse compromettendo la vita di relazione e professionale dell’individuo “affetto”.
Sebbene alcune di esse rappresentino condizioni veritiere legate all’aberrante e non certo costruttivo uso che si fa del bodybuilding, altrettanto vere sono due considerazioni che devono, all’uopo, essere necessariamente palesate in quanto fin troppo misconosciute (in particolare la seconda di esse):
- i motivi dell’approccio al bodybuilding non sono uguali per tutti e chi intraprende tale disciplina non può essere accomunato, pertanto, a coloro che di una pratica sana ne fanno una aberrante che estromette l’individuo dal sociale e che per tale motivo, a ragione, non risulta più “salutare” ma “patologica” .
- Prerogativa di pochi è la conoscenza del rigor scientifico che supporta e plasma gli effetti salubri derivanti dalla pratica reiterata e costante di tale disciplina e anche, e soprattutto, del suo stile di vita.
Invece, nozione comune tipica dell’uomo medio (e non edotto in materia) è quella che, attraverso spiccioli abbozzi di saggezza, rimanda gli effetti benefici dell’attività fisica al buon adagio: “fare moto fa bene”!
Che è ben lungi dal mettere in risalto le fini, intricate ed integrate alterazioni metaboliche e di substrato, su diversi livelli, occorrenti in risposta all’allenamento pesi di impronta culturistica che dota l’individuo che lo pratica di uno status fisiologico-organico di significativa unicità, rispetto alla pratica di altre forme di esercizio fisico, ai fini salutistici.
Nel presente articolo il sottoscritto approfondirà – e supporterà con ampia e relativa letteratura –
gli aspetti salutistici centrali e periferici, strutturali e funzionali che prospetticamente possono essere demandati all’allenamento in generale, ed ancor di più quando questo si riferisce al contesto specifico dell’allenamento pesi e se questo, a sua volta, viene ad applicarsi secondo gli indirizzi specialistici della disciplina del bodybuilding.
BODYBUILDING VS. INFIAMMAZIONE CRONICA SISTEMICA SILENTE
Quindi, si evincerà quanto lo stile di vita proprio del bodybuilding sarà funzionale alla prosperità della salute del singolo su vari livelli: dalla neurogenesi e plasticità sinaptica, agli effetti anti-infiammatori e controregolatori verso tutte quelle patologie cronico-degenerative (patologie neurodegenrative, patologie cardiovascolari, tumori, patologie autoimmuni, etc.) legate ai processi infiammatori (ci si riferisce all’infiammazione cronica e silente e non a quella di tipo acuto).
Si vedrà come tutti gli accorgimenti che vengono messi in atto per promuovere crescita muscolare e/o miglioramento della composizione corporea determinano delle ripercussioni enzimatiche, metaboliche, ormonali e di segnalazione cellulare completamente in antitesi ai processi infiammatori che predispongono il terreno verso le patologie cronico-degenerative su base infiammatoria.
ALLOSTASI, SOVRACCARICO ALLOSTATICO E BODYBUILDING
Premesso che l’organismo è sottoposto a stimoli esogeni ed endogeni di diversa natura che recepisce attraverso i suoi diversi sistemi – dalla cui interazione integrata ne deriva la risposta adattativa funzionale a garantire la sopravvivenza dell’individuo – è pur vero che non sempre la stessa è anche funzionale alla longevità dello stesso.
E’ il caso di tipi di stressors che per la loro accezione cronica creano danni per diversi motivi:
1) perché superano la soglia di allostasi – cioè il corpo non riesce, in risposta ad essi, a soddisfare il presupposto del raggiungimento di stabilità attraverso il cambiamento –
2) quando il sistema di allostasi è inefficiente – cioè non riesce ad arrestare le risposte quando non sono più necessarie –
3) quando il corpo non è in grado di rispondere in modo adeguato allo stressor da subito o quando non riesce ad abituarsi a rispondere ad uno stesso ed identico tipo di stressor inibendo, dunque, qualsiasi tipologia di risposta allostatica.
Tutte queste condizioni degenerano nel sovraccarico allostatico che, al contrario dell’allostasi, determina degli adattamenti a condizioni fisiopatologiche che volgono a detrimento della salute dell’individuo1.
Si vedrà, sulla base di quanto premesso, come l’allenamento specifico-specialistico summenzionato inquadrato in qualità stressor di tipo acuto (in virtù dell’elevata intensità e breve durata che lo caratterizzano) e reiterato nel tempo in modo programmato ed organizzato non solo soddisfa appieno il concetto di stato allostatico, ma gli stimoli metabolici e conseguentemente ormonali che – ne plasmano i connotati strutturali-specialistici – lo stesso provoca inducono risposte adattative funzionali e strutturali che non solo permettono, in seguito, all’individuo di rispondere in modo ancora più performante allo stress allenante ma producono vantaggi a diversi livelli che rispondono all’esigenza di rendere l’individuo più longevo.
Parlare di allenamento di bodybuilding in un’ottica prospettica di longevità non può esulare dall’adozione dello stile di vita “tipo” del bodybuilder.
Infatti, è l’approccio nutrizionale-supplementare ed il riposo che determinano il potenziale di produrre adattamenti vantaggiosi a partire dagli stimoli creati dall’allenamento ed al contempo, pertanto, di non consentire agli stessi di produrre fenomeni di sovraccarico allostatico.
Sebbene, dunque, il regime nutrizionale-supplementare ed il riposo siano fattori deterministici sulla qualità delle sorti adattative degli stressors allenanti, nella presente esposizione si farà solo un breve cenno all’ampia gamma e rassegna di quelli che dovrebbero essere i capisaldi di tali fattori per l’ottimizzazione degli adattamenti; e ciò al fine di dare più spazio alle ripercussioni allenanti sui vari sistemi e sulla salute dell’individuo.
Il vantaggio salutistico dell’allenamento culturistico risiede nel fatto che i pattern metabolici, ormonali e immunologici che si instaurano in risposta alle tipologie di allenamenti miranti all’ipertrofia (che come si vedrà è già fonte di salute essa stessa) presentano profonde conseguenze anche a livello centrale (nei termini di: neurogenesi, plasticità sinaptica, arborizzazione dendritica dei neuroni neoformati, inibizione dei processi infiammatori centrali), a livello metabolico e del sistema immune2,3.
INTENSITA’
Tali circuiti si innescano in funzione di diversi parametri dell’allenamento: intensità e durata della sessione allenante.
L’intensità è la variabile dipendente da tre principali fattori determinanti (carico utilizzato, numero di ripetizioni, periodo di ristoro tra le serie).
L’entità del carico determina il numero di ripetizioni.
Il numero di ripetizioni determina la durata delle tensione muscolare continua.
Il periodo di ristoro determina il tipo di metabolismo energetico col quale si proseguirà il resto delle serie e, quindi, anche il carico da usare in funzione del numero di ripetizioni che si intende eseguire.
La variazione di una o più di tali variabili determina variazioni nell’intensità.
Variazioni nell’intensità inducono variazioni nel tipo di metabolismo energetico e, quindi, conseguentemente anche nel pattern ormonale evocato.
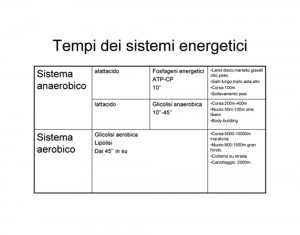
Uno dei più accreditati e scientificamente dimostrabili approcci d’intensità per l’ipertrofia prevede la combinazione di un numero di ripetizioni, tempo di recupero e resistenza esterna tali da portare al cedimento muscolare all’interno di un contesto metabolico anaerobico lattacido.
Come si vedrà il cedimento muscolare adattato ad un contesto metabolico anaerobico lattacido è fonte di stimolazioni di diversa natura responsabili ultimi dell’attivazione/fosforilazione di fattori di segnalazione cellulare legati ai processi ipertrofici4.
METABOLISMO ANAEROBICO-LATTACIDO E CRESCITA MUSCOLARE
ORMONE DELLA CRESCITA
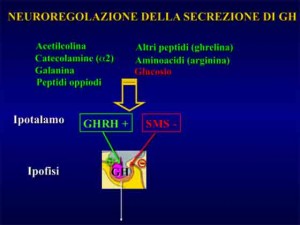
L’ormone della crescita e’ un polipeptide di 191 aminoacidi secreto dall’ipofisi anteriore.
L’ormone della crescita – più comunemente conosciuto con la sua sigla-acronimo inglese: “GH”- tra le sue funzioni biologiche quelle che ci riguardano direttamente relativamente al tal contesto sono gli effetti sui diversi substrati metabolici.
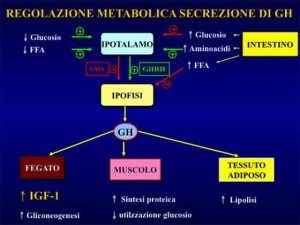
Tali effetti sono: incrementata sintesi proteica, ridotto catabolismo proteico-tissutale e mobilizzazione dei grassi dal tessuto adiposo (lipolisi). Esercita anche un certo effetto glicogenolitico e, pertanto, in tal contesto svolge azione iperglicemizzante.
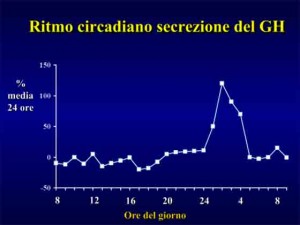
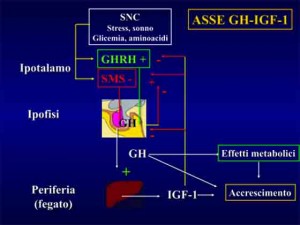
In condizioni di riposo la secrezione pulsatile del GH e’ condizionata da diversi fattori quali: età, sesso, stato nutrizionale, sonno, composizione corporea, distribuzione regionale del tessuto adiposo, stress, livello d’allenamento, ormoni sessuali (testosterone, estrogeni), insulina ed IGF-1.
Fra questi elencati i due più influenti nell’inficiare sulla portata della sua secrezione a riposo sono risultati: 1) il grasso addominale (viscerale) e 2) i livelli di insulina a digiuno (variabili in funzione di diverse condizioni: alimentazione, dote genetica, stato di allenamento etc.).
Ma tra questi due quello più influente si e’ rivelato il livello di grasso addominale5.
GH ED ESERCISIO FISICO
L’esercizio fisico ad alta intensità e’ dimostrato essere il più potente “stimolo esterno non farmacologico” della secrezione dell’ormone della crescita.
Più precisamente sono le conseguenze metaboliche derivanti dall’allenamento intenso che rendono ragione di un’associazione diretta tra lo stesso e l’incrementata secrezione di ormone della crescita.
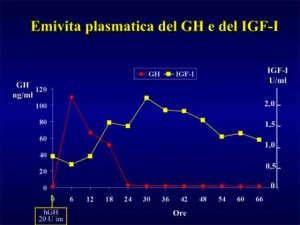
L’allenamento intenso determina un’importante formazione di acido lattico e questo e’ positivamente correlato alla secrezione del GH.
In uno studio e’ stata riportata una risposta dose-dipendente tra l’acido lattico prodotto ed i livelli di ormone della crescita plasmatici in risposta a protocolli di corsa di bassa ed alta intensità6.
Si e’ valutata la secrezione di GH per i 5 diversi livelli di intensità di corsa in funzione delle diverse percentuali di soglia lattacida indotta dai singoli protocolli di lavoro nei soggetti.
La soglia lattacida rappresenta l’intensità di esercizio fisico per la quale l’acido lattico inizia ad accumularsi nel sangue.
La risposta del GH fu la più bassa in corrispondenza del più basso livello di produzione di acido lattico e la più elevata in corrispondenza di elevate concentrazioni di acido lattico accumulato.
L’esercizio ad alta intensità porta ad una elevata produzione di acido lattico e questo influenza positivamente i livelli di ormone della crescita.
L’intensità, in fisica, è la quantità di flusso energetico nel tempo medio. Per trovare l’intensità si prenda la densità energetica (cioè l’energia per unità di volume) e la si moltiplichi per la velocità alla quale essa si muove.
Nel nostro caso, quello dell’allenamento pesi, per intensità si intende il livello di output energetico netto dato dalla sessione di lavoro. Questo e’ la risultante del numero di ripetizioni, peso sollevato e tempo di recupero tra le serie.
Il carico allenante determina il numero di ripetizioni, il numero di ripetizioni il tipo di substrato metabolico e questo la natura dei prodotti finali del metabolismo energetico.
La quantità del tempo di recupero determina l’incremento, il preservamento o la diminuzione d’intensità nell’ambito delle serie successive.
Nel qual caso numero di ripetizioni e carico allenante fossero modulati per indurre un accumulo di acido lattico, la lunghezza della pausa tra le serie determinerebbe il potenziale di accumulo di acido lattico nell’arco dell’intera seduta allenante. Tempi di recupero lunghi a sufficienza da consentire una massiccia azione di buffering da parte di sistemi tampone (HCO3=ione bicarbonato) e da parte delle fibre rosse (grazie alla loro capacità di riconversione dell’acido lattico in acido piruvico per mezzo degli isoenzimi LDH1 e LDH2 che popolano le fibre in questione) inficerebbero sulla portata quantitativa di accumulo di acido lattico alla fine dell’allenamento e del suo mantenimento nel corso della seduta stessa.
Quindi, lunghi tempi di recupero non supportano significativi incrementi di GH durante l’esercizio fisico.
A supporto di ciò è uno studio di Gordon et al., nel quale si riporta che nonostante l’utilizzo di grossi carichi durante l’allenamento, se questo non è inserito in un contesto ad alta intensità non vi è una massiccia produzione di acido lattico e quindi anche la risposta relativa alla portata incretiva di GH è attenuata7.
In questo studio per dimostrare quanto l’accumulo di acido lattico sia condizionante sulla susseguente risposta di GH, i ricercatori hanno somministrato del sodio bicarbonato (il bicarbonato di sodio riduce l’accumulo di acido lattico nel sangue, innalza il ph del sangue rendendo, quindi, il ph ematico meno acido) a degli atleti sottoposti ad un test di sforzo fisico sul cicloergometro fino al raggiungimento dell’esaurimento muscolare.
La somministrazione di bicarbonato di sodio è risultata in un decrementato livello lattacidemico (acido lattico nel sangue) e conseguentemente in una altrettanta ridotta secrezione di ormone della crescita in risposta all’esercizio fisico.
Programmi d’allenamento di volume moderato che prevedono brevi intervalli di recupero (meno di un minuto) e che producono elevati livelli di acido lattico durante l’esercizio risultano in elevate risposte secretive di GH rispetto a protocolli di lavoro ad alto volume con lunghe pause di recupero tra le serie (oltre i 5 minuti).
L’ormone somatotropo (GH) esercita diversi effetti metabolici tra cui quelli di incrementata sintesi proteica. La crescita muscolare indotta dall’ormone della crescita è IGF-1 mediata8.
Pertanto uno dei meccanismi attraverso i quali l’allenamento pesi stimola i processi ipertrofici è dato dalla secrezione epatica di IGF-1 sotto azione dello stimolo tropico somatotropo.
Inoltre, ad intervenire sulla crescita muscolare sono anche le isoforme di IGF-1 prodotte localmente a partire dagli stimoli di carico concentrico ed eccentrico a livello muscolare dopo esercizio fisico di resistenza9. Questo dimostra quanto la produzione di IGF-1 non sia solo di prerogativa epatica ma anche muscolare e regolata da stimoli di differente natura (somotatropo e biomeccanico).
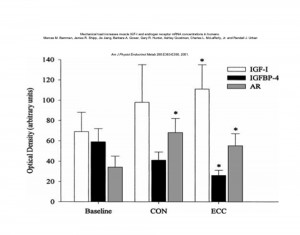
Anche la qualità del tipo di contrazione ha effetti sulla portata quantitativa nella secrezione locale di somatomedine e negli adattamenti ad esse affini.
La contrazione eccentrica induce livelli più elevati di IGF-1 muscolare e contemporaneamente valori più depressi di IGFBP-410.
L’immagine che segue chiarisce il diverso impatto ed effetto dei diversi tipi di contrazione (concentrica ed eccentrica) su diversi aspetti adattativi, di substrato (espressione dei recettori agli androgeni) ed ormonali (produzione di somatomedine).
CEDIMENTO/ESAURIMENTO MUSCOLARE
Nella fattispecie dell’allenamento culturistico il cedimento muscolare è rappresentato dal grado di affaticamento metabolico (indotto dall’esercizio continuativo per ciclo di movimento e cioè dal numero di ripetizioni totali previsto per singola serie dell’esercizio di riferimento) al quale corrisponde l’incapacità muscolare di portare a termine un’ulteriore ripetizione eseguita in modo completo e corretto.
I processi anabolici miofibrillari e sarcoplasmatici sono più spiccati a seguito di allenamento condotto a cedimento muscolare entro un’intensità metabolica anaerobica lattacida.
Ciò è in linea alle variazioni intracellulari dei fattori di segnalazione responsabili degli stessi processi ipertrofici:
- Incrementata attivazione di mTOR 1h post-exercise11
- Incrementata fosforilazione della 4EBP1 nelle 4 e 24 h post exercise
- Incrementata espressione genica di eEF2 nelle 24 h post-exercise
- Incrementata fosforilazione di p70S6k
- Diminuita espressione di Pax7
- Incremento dell’espressione genica di Miogenina
- Incremento della MyoD
In un recente studio, dal quale sono emerse le evidenze qui sopra riportate, si è voluto mettere alla luce quale tipologia di intensità d’allenamento muscolare fosse più impattante a livello dei processi anabolico-tissutali (crescita muscolare).
IN BREVE
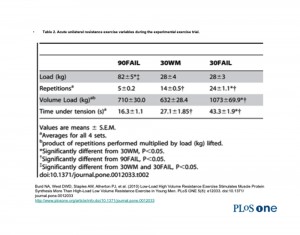
Nello studio si sono osservate le risposte metaboliche e di segnalazione cellulare (mediatrici dei processi ipertrofici) in risposta a 3 livelli di intensità condotti durante l’esecuzione di 4 serie unilaterali di “leg extension”.
Un gruppo (denominato: “90 FAIL”) eseguiva l’esercizio portandolo al cedimento con un carico pari al 90% del carico massimale (1 RM).
Un secondo gruppo (denominato: “30 WM”), eseguiva lo stesso numero di ripetizioni eseguito dal gruppo “90 FAIL” ma con un carico pari al 30% del carico massimale (1 RM) e, ovviamente, senza arrivare al cedimento.
Un terzo gruppo (denominato: “30 FAIL”) eseguiva l’esercizio fino a cedimento muscolare con un carico pari al 30% del carico massimale (1 RM).
E’ risultato che i fattori di segnalazione cellulare che codificano per le sintesi proteiche erano più spiccati in corrispondenza del gruppo che aveva condotto l’allenamento a cedimento con un carico moderato (cioè il gruppo “30 FAIL”).
Ed, infatti, anche i processi anabolici sarcoplasmatici e miofibrillari risultavano spiccatamente a favore di tale intensità nel condurre l’allenamento rispetto alle altre due previste dallo studio.
Tutto ciò e verosimilmente in linea a quanto menzionato in precedenza e cioè a quanto l’allenamento di tipo anaerobico-lattacido sia una condizione metabolico-energetica trigger per gli eventi proteogenici.
Infatti, osservando la seguenti tabelle, si può constatare come il tempo di tensione continua previsto dall’intensità del gruppo “30 FAIL” ricada adeguatamente entro la sfera di competenza del metabolismo anaerobico-lattacido.
Inoltre, ai fini della crescita muscolare costituisce presupposto essenziale la durata della sessione allenante.
Ai fini di indurre valori più elevati nel rapporto tra ormoni anabolici e catabolici, la durata dell’allenamento intenso dovrebbe rimanere confinata ai 40 minuti12.
BREVI CENNI SU STRATEGIE NUTRIZIONALI-INTEGRAZIONALI AI FINI IPERTROFICI
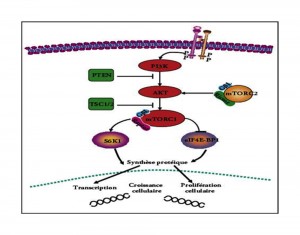
Premesso che gli adattamenti ipertrofici sono indotti dalla sinergia tra l’attivazione/reclutamento di cellule satellite e l’incrementata sintesi proteica, l’attivazione del downstream indotto dalla stimolazione di mTOR agisce positivamente sui processi di sintesi proteica.
mTOR è una serina/treonina chinasi conservata.
mTOR esiste in 2 forme/complessi: TORC1 e TORC2.
Solo TORC1 è coinvolto nella regolazione dei processi metabolici e della crescita cellulare che a livello della muscolatura scheletrica striata sottoposta ad esercizio fisico si traduce in aumento delle dimensioni delle fibre muscolari.
TORC1 è attivato da stimoli di diversa natura: ormonali, fattori di crescita, nutrienti e di meccano-trasduzione.
Lo stile di vita dell’approccio culturistico ricalca la tipologia di tali stimoli.
Come si è visto il tipo di allenamento è funzionale a secrezioni ormonali che attivano il pathway PI3K-Akt-mTOR e lo stesso allenamento rappresenta stimolo di meccano-trasduzione in grado di attivare in modo diretto TORC1.
Come si vedrà di seguito, gli stimoli nutrizionali e di supplementazione e le dirette risposte ormonali dagli stessi evocate sono altrettanto fondamentali in un approccio sinergico agli stimoli allenanti diretti ed ormono-mediati per il mantenimento dell’attivazione di TORC1.
Alcuni degli approcci strategico-nutrizionali-supplementari adottati nel bodybuilding d’elite sono rappresentati da quelli contestualizzati nella finestra del preworkout e del postworkout.
Gli accorgimenti dietetico-supplementari adottati prevedono l’utilizzo di miscele composite prevalentemente da: substrati proteici del siero di latte, aminoacidi essenziali, aminoacidi a catena ramificata, glucidi ad elevato indice glicemico.
Tali abbinamenti nutritizi sono volti ad indurre output metabolici (incremento dei valori glicemici), enzimatici (incremento dell’attività della glicogenosintetasi) ed ormonali (incremento dei valori insulinemici) atti a favorire, supportare ed amplificare gli stimoli anabolici di diversa natura indotti dall’esercizio fisico di resistenza nonché nel far sì che le stimolazioni anaboliche indotte da esercizio fisico e dall’approccio nutrizionale-supplementare integrato si risolvano in adattamenti anabolici di substrato: ipertrofia muscolare, glicogenosintesi.
Il razionale dietro tali approcci riconduce sempre alla stimolazione del fattore di segnalazione cellulare mTOR in seno al complesso TORC1 dal quale dipendono gli adattamenti summenzionati.
Gli aminoacidi essenziali attivano mTOR, e soprattutto la leucina risulta implicata nella fosforilazione di p70S6K responsabile a sua volta di fosforilare sub-unità di mRNA codificanti per proteine ribosomiali e fattori di elongazione entrambe coinvolti nell’indurre un’incrementata capacità di traduzione13.
All’attivazione di mTOR seguono processi altamente onerosi da un punto di vista energetico. Pertanto, qualunque sia lo stimolo sull’attivazione di mTOR, la sua attivazione non può sostenersi indipendentemente dalla coesistenza di un contesto energetico appropriato e per due motivi principali:
1) il contesto metabolico deve essere funzionale ad una adeguata concentrazione di insulina poiché la stimolazione di mTOR da parte degli aminoacidi essenziali è insulino-mediata13.
2) Bassi livelli plasmatici di glucosio e quindi di ATP attivano l’AMPK che inibisce l’attivazione di mTOR13.
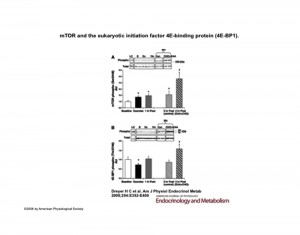
L’assunzione di una miscela di aminoacidi essenziali arricchita di leucina combinata a carboidrati un’ora dopo allenamento di resistenza determina valori incrementali nella fosforilazione di mTOR, S6K1 e 4EBP1 e conseguente aumento delle sintesi proteiche11.
L’assunzione di una bevanda composita di glucidi pari a 0,8g/kg/h insieme ad una miscela di aminoacidi e proteine idrolizzate pari a 0,4g/kg/h nel periodo di ristoro post allenamento determina i seguenti effetti metabolici e di substrato:
1) Tasso di risintesi del glicogeno superiore rispetto al consumo di una bevanda isoglucidica.
2) Sintesi quantitativa di glicogeno muscolare superiore rispetto al consumo di una bevanda isoglucidica14.
L’intera cascata di segnalazioni cellulari inducenti gli adattamenti ipertrofici potrebbe essere completamente relegata all’attivazione di mTOR ed al relativo pathway di segnalazione cellulare PI3K-Akt-mTOR.
Dato l’allenamento pesi quale comune denominatore alle secrezioni ormonali somatotrope e all’attivazione del pathway innescante i processi di sintesi proteica e considerato che tra gli stimoli attivanti il pathway rientra anche l’IGF-1 è chiaro che la connessione tra l’allenamento e l’attivazione del pathway responsabile dei processi ipertrofici è anche ormono-mediata.
Come si potrà constatare, di seguito, i fattori ormonali e neurotrofine indotte dall’allenamento di resistenza – che forgia la tipologia dell’allenamento dell’approccio culturistico all’utilizzo di macchinari dedicati, manubri e bilancieri – e le conseguenti chinasi proteiche ormono-indotte innescate dall’allenamento stesso sono coinvolti anche nei processi di neurogenesi, plasticità sinaptica ed arborizzazione dendritica.
Il pathway PI3K-Akt-mTOR ormono-indotto, gli stessi ormoni indotti dall’allenamento anaerobico-lattacido evocato dall’esercizio fisico di resistenza tipico del bodybuilding, lo stesso allenamento di resistenza e l’aumento della massa muscolare sono responsabili nel favorire il miglioramento delle funzioni cognitive di apprendimento e memoria legati a miglioramenti nella plasticità sinaptica e fenomeni di neurogenesi a livello della zona subgranulare del giro dentato e della zona subventricolare dell’ippocampo.
1) Il pathway PI3K-Akt-mTOR favorisce la sopravvivenza di neuroni neoformati e l’arborizzazione dendritica15.
2) L’allenamento di resistenza (tipico del bodybuilding) incrementa i livelli circolanti di BDNF.
Il BDNF è una neurotrofina responsabile della differenziazione e sopravvivenza dei neuroni nonché della arborizzazione dendritica e del potenziamento sinaptico a lungo termine; favorendo processi di plasticità sinaptica migliora i processi di apprendimento e memoria16.
3) L’IGF-1 è correlato positivamente con la plasticità sinaptica ed incrementa i processi di neurogenesi17,8.
4) Valori incrementali di massa muscolare scheletrica sono correlati positivamente a valori incrementali di FGF-2 e la sua espressione è PI3K/Akt pathway dipendente18,19; L’FGF-2 è fattore di crescita promotore della neurogenesi nonché fattore che garantisce la sopravvivenza neuronale e lo sviluppo del neurite21,22.
5) L’allenamento aerobico ed anche l’allenamento di resistenza favoriscono l’incremento dei livelli sierici di VEGF.13,3 Anch’esso regolatore della neurogenesi nella zona subventricolare dell’ippocampo e più precisamente modulante i processi di proliferazione e migrazione dei fibroblasti22.
6) Valori incrementali di massa muscolare scheletrica sono negativamente correlati a livelli sierici di due markers pro-infiammatori: Proteina C Reattiva e TNF-α3. Ridotti livelli di TNF-α rappresentano il risultato di minor proliferazione di cellule gliali a livello centrale e regolatori negativi dei processi di neurodegenerazione e decadimento della plasticità sinaptica23.
Tali fini adattamenti sono completamente in antitesi ai processi pro-infiammatori (indotti da uno stile di vita scorretto: sedentarietà e stile alimentare inappropriato) che presiedono, anche e non solo, alle patologie neurodegenerative (e.g.: malattia di Alzheimer).
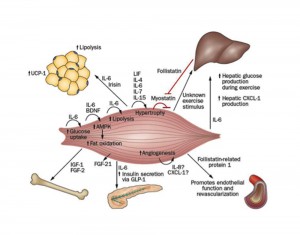
MIOCHINE, ESERCIZIO FISICO E SALUTE
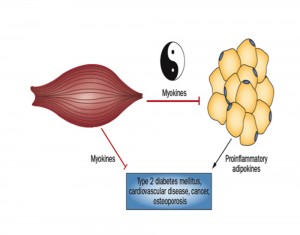
Infatti, le miochine – parte del secretoma del muscolo scheletrico striato – presentano un’elevata azione antiinfiammatoria contrastante quella pro-infiammatoria delle adipochine proprie del tessuto adiposo; queste ultime sarebbero le responsabili dell’incalzare e dello strutturarsi di un ambiente infiammatorio su base cronica promuovente alterazioni patologiche, quali: osteoporosi, diabete mellito di tipo 2, insulino resistenza, aterosclerosi, cancro.
Le miochine sono citochine o altri peptidi che vengono prodotti, espressi e rilasciati dalle fibre muscolari ed esercitano attività endocrina24.
Tra le miochine al momento identificate, vi sono: MIOSTATINA, BDNF, IGF-1, FGF-2, FGF-21, FSTL-1, IRISINA, LIF, IL-4, IL-6, IL-7, IL-8, IL-15.
MIOSTATINA
La Miostatina rappresenta il primo fattore muscolare riconosciuto e soddisfacente il criterio di “miochina”.
E’ un membro della superfamiglia delle TGF-B.
L’inattivazione (knockout) del gene della miostatina risulta in una conseguente e drammatica ipertrofia muscolare, nei topi e negli essere umani46,47.
Al di là del ruolo regolatorio della miostatina sui processi di crescita muscolare, questa miochina è altresì coinvolta nel mantenimento dell’omeostasi metabolica e nella modulazione delle dimensioni e funzione del tessuto adiposo48,49.
L’inibizione del gene della miostatina nei topi produce contemporaneamente ipertrofia muscolare e decremento del tessuto adiposo totale50,51.
Negli esseri umani e nei roditori gli esercizi di forza attenuano l’espressione della miostatina e la sua inattivazione sembrerebbe potenziare gli effetti benefici indotti dagli esercizi di endurance sul metabolismo52.
Ancora, in un altro studio Drummond et al. 54 hanno messo in evidenza come allenamenti di resistenza determinano un sensibile decremento dei livelli di miostatina dopo 3 ore dalla fine della sessione di allenamento.
Tali evidenze suggeriscono che l’abbassamento dei livelli di miostatina nella finestra temporale post-exercise risulta in maggiori livelli di ipertrofia muscolare55,56,57.
Invece Roth et al. hanno osservato una diminuita espressione del gene per l’mRNA della miostatina in seguito ad esercizio di resistenza condotto al 75-85% del massimale (1RM) per un periodo di 9 settimane con contemporaneo incremento dei livelli ipertrofici e di forza55 .
N.B.: Intensità pari al 75-85% del massimale sono tipiche dell’allenamento di bodybuilding.
Le evidenze dimostrano che l’obesità è associata ad una incrementata espressione della miostatina.
I livelli di miostatina muscolari e circolanti risultano incrementati in soggetti obesi.
Inoltre, i livelli di miostatina secreti da miotubuli derivanti dai mioblasti isolati da campioni di biopsia muscolare risultano più elevati in donne obese rispetto a donne magre53.
IL-7
Agisce sulla differenziazione delle cellule dell’immunità adattativa: Linfociti T e Linfociti B.
E’ stato, inoltre, riscontrato che i livelli di IL-7 risultavano fortemente elevati nei muscoli a riposo di soggetti che avevano intrapreso un programma di allenamento della forza25.
IL-8
E’ una chemochina poiché esercita attività chemotattica sui leucociti. Inoltre è un fattore angiogenico, cioè migliora la vascolarizzazione muscolare26.
IGF-1 e FGF-2
Agiscono come fattori osteogenici, cioè favoriscono l’anabolismo osseo (fenomeno in antitesi con i fenomeni osteoclastici tipici dell’osteoporosi; ecco un’altra ragione per la quale allenarsi con vigore giova alla salute in generale ed anche a quella delle ossa).
I recettori di questi due fattori di crescita sono localizzati nel periostio a livello dell’interfaccia muscolo-osso.
Questo suggerisce che IGF-1 e FGF-2 sono coinvolti in rapporti di comunicazione incrociata (crosstalk) tra muscolo ed osso29.
IL-15
Questa miochina fa parte della super famiglia della IL-2 ed è espressa nel muscolo scheletrico striato.
Oltre i suoi effetti anabolici sul tessuto muscolare scheletrico striato presenta un ruolo importante anche a livello del metabolismo lipidico.
L’IL-15 decrementa il deposito di lipidi in seno ai pre-adipociti ed altresì determina una diminuzione del tessuto adiposo bianco (grasso viscerale) 27,28.
E’ stata riscontrata un’associazione negativa tra i livelli plasmatici di IL-15 ed il tessuto adiposo totale, il tessuto adiposo espresso in percentuale ed il tessuto adiposo del tronco.
L’inattività fisica conduce ad una perdita di massa muscolare ed al contemporaneo aumento di grasso viscerale e le evidenze supportano la nozione che l’IL-15 sia fortemente coinvolta nella regolazione del livello di adiposità addominale.
LIF
Il LIF è responsabile della formazione piastrinica, delle ossa, della proliferazione delle cellule ematopoietiche e della sopravvivenza e proliferazione neurale. E’ inoltre responsabile della fase di produzione acuta degli epatociti30.
Il LIF induce la proliferazione delle cellule satellite, evento essenziale per un’appropriato processo di ipertrofia muscolare e rigenerazione31.
L’espressione dell’mRNA del LIF avviene a livello del muscolo scheletrico striato in seguito ad allenamento di resistenza e da ulteriori evidenze è emerso che trattasi di una miochina la cui secrezione è contrazione-indotta32.
IRISINA
E’ responsabile del browning of fat, cioè della conversione del tessuto adiposo bianco in quello bruno ed i suoi livelli basali si elevano in risposta a 10 settimane di costante e regolare pratica di esercizio fisico. E ciò suggerisce che l’Irisina ha un ruolo importante a livello degli effetti allenanti in risposta all’esercizio fisico33.
IL-6
Questa miochina ha destato molto interesse nei ricercatori, infatti è una delle miochine che esercita grande attività antiinfiammatoria e risulta elevata in seguito a contrazioni muscolari di una certa intensità.
E’ stata qualificata come miochina quasi per caso; infatti si era visto che i suoi livelli incrementavano esponenzialmente ed in proporzione alla lunghezza dell’allenamento ed alla quantità di masse muscolari reclutate durante l’esercizio34.
I livelli di IL-6 incrementano in seguito a depauperamento delle riserve di glicogeno muscolare. Pertanto, in tal caso, l’IL-6 agisce come sensore dei livelli energetici35,36.
In seguito a ciò, e cioè di livelli elevati di IL-6, incrementa anche la captazione muscolare del glucosio ematico nonché la traslocazione dei GLUT4 dal sarcoplasma al sarcolemma37.
Inoltre, l’incremento dei livelli di IL-6 favorisce l’incremento della sensibilità all’insulina da parte del corpo.
Ancora, l’IL-6 favorisce l’ossidazione degli acidi grassi intramiocellulari e quella totale del corpo37,38,39,40.
L’IL-6 in sintonia con quanto sopra descritto circa il metabolismo del glucosio – dato che i suoi livelli aumentano in corrispondenza di bassi livelli di glicogeno muscolare – favorisce la produzione di glucosio epatico in corso di esercizio fisico41.
Si è visto che quando a soggetti sani in corso di esercizio fisico di bassa intensità fu somministrata IL-6, la produzione di glucosio epatico risultava essere alta quanto durante esercizio fisico ad alta intensità.
Questo dimostra una comunicazione incrociata (crosstalk) tra muscolo e fegato.
L’infusione di IL-6 in soggetti sani ha altresì determinato un incremento della lipolisi in assenza di ipertrigliceridemia o variazioni nei livelli di catecolamine, insulina, glucagone38,39,42.
L’IL-6 ha effetti diretti sia sulla lipolisi quanto sull’ossidazione degli acidi grassi e queste caratteristiche identificano l’interleuchina 6 (IL-6) come un fattore lipolitico38.
L’interleuchina 6 media anche alcuni degli effetti antiinfiammatori ed immunoregolatori demandati all’esercizio fisico43,44.
I suoi effetti antiinfiammatori sono anche dimostrati dalla capacità che possiede l’IL-6 nello stimolare la produzione delle classiche ed antiinfiammatorie citochine IL-1ra e IL-1045.
Come si può dedurre dalle evidenze sugli effetti metabolici di pertinenza della IL-6, elevati valori della stessa ma soprattutto gli simoli biomeccanico-fisici che la portano ad elevarsi sono in piena contrapposizione ed antitesi alle alterazioni fisiopatologiche che caratterizzano la sindrome metabolica.
In sintesi non vi sarà mai alcun individuo dotato di buona composizione corporea (massa muscolare minimo 40% della massa magra, grasso totale non superiore al 25% e grasso viscerale sotto i 560 cm2) che conduca uno stile di vita salubre nel quale rientra anche esercizio fisico vigoroso che possa essere oggetto della costellazione di tutte quelle alterazioni metaboliche (resistenza all’insulina, dislipidemia, obesità, iperglicemia, ipertensione) che conclamano la sindrome stessa.
Ed effetti benefici a tal fine possono essere relegati anche alle caratteristiche metaboliche delle altre miochine elencate: IL-15 che favorisce la diminuzione del grasso totale ma anche di quello bianco viscerale, l’IRISINA che trasforma il grasso bianco (viscerale, quello pro-infiammatorio) in grasso bruno.
Queste caratteristiche insieme al grado antiinfiammatorio le pongono a suon di evidenze in contrasto con il sorgere e svilupparsi di tutte quelle patologie croniche di tipo infiammatorio.
Ecco, quindi, che i benefici effetti sulla salute derivanti da esercizio fisico vigoroso sono mediati dalle miochine secrete in corso di esercizio fisico.
Più sono importanti i livelli di massa muscolare scheletrica più importante da un punto di vista quantitativo è il secreto di tali citochine di derivazione muscolare.
SISTEMA D’ALLENAMENTO
Premettendo che nessun sistema d’allenamento rappresenta uno stimolo allenante efficace in assoluto e per sempre se protratto eternamente nella sua durata, da un’analisi delle componenti strutturali e perciò anche metaboliche delle fibre muscolari finalizzata a sondare quali presupposti lo stimolo allenante deve possedere per indurre tali loro specifiche componenti funzionali e metaboliche ai fini della stimolazione del pattern ormonale più confacente al nostro discorso: “l’ipertrofia”, uno dei migliori sistemi d’allenamento per stimolare ottimamente la risposta adrenergica e somatotropa allo stress fisico acuto e’ rappresentato dalle super serie tra muscoli antagonisti.
1)Il medio-elevato numero di ripetizioni consente una produzione di acido lattico e di catecolamine più sostenuta nel tempo.
2)Il medio-elevato numero di ripetizioni non compromette la potenza lattacida della risposta muscolare e dell’attivazione adrenergica, anzi la amplifica. Ciò è possibile poiché il numero totale di ripetizioni che si compie in una serie in superserie antagonista (ad esempio: Distensioni su panca per il petto 1×10 e Rematore con bilanciere 1×10 = 20 ripetizioni in totale) non è di competenza di un singolo distretto muscolare e, pertanto, il lavoro distrettuale rimane confinato entro il range che si otterrebbe allenando i singoli gruppi muscolari separatamente con un numero medio di ripetizioni (nell’esempio specifico 10 ripetizioni) e ciò consente di preservare la qualità del reclutamento muscolare corrispondente.
3) Allenare agonisti ed antagonisti in superserie consente di disporre – per fattori di origine nervosa (aumentata scarica delle fibre periferiche afferenti “Ib”) indotti dal lavoro eseguito dal gruppo muscolare allenato per primo – di un reclutamento muscolare superiore a favore del distretto muscolare allenato come secondo (riflesso miotatico inverso) rispetto ad allenarli separatamente non in condizioni di superserie .
4)Il limitato tempo di recupero tra le super serie consente di preservare l’intensità allenante nelle serie successive e di salvaguardare l’ambiente acido prodotto dal lavoro muscolare con carichi intesi al raggiungimento del cedimento muscolare per lo specifico range di ripetizioni suggerito (6-10).
5)La durata totale dell’allenamento è inferiore rispetto a quella derivante dall’allenamento dei due gruppi muscolari in una condizione diversa dalle superserie. Questo, come risaputo, è un elemento di indubbio vantaggio nel contenere la risposta catabolica cortisolemica quale adattamento ad uno stressor (esercizio fisico) prolungato nel tempo.
Infatti, l’allenamento confinato entro i 40 minuti di tempo crea valori superiori nel rapporto tra ormoni anabolici e catabolici rispetto a periodi di allenamento più duraturi12.
Allenamento e salute, alla luce di quanto emerge dalla presente esposizione e dalla ricerca scientifica, è l’inscindibile binomio anti-dualista che trova maggior espressione del suo sinergismo e delle sue “verità metaboliche” in seno a quello stile di vita che forgia e trova sostanza nel bodybuilding.
Del dott. Francesco Casillo
BIBLIOGRAFIA
1) Bruce S. McEwen. Central effects of stress hormones in health and disease:
understanding the protective and damaging effects of stress and
stress mediators. Eur J Pharmacol. 2008 April 7; 583(2-3): 174–185.
2) Neurosci Lett. 2010 Jul 26;479(2):161-5. Epub 2010 May 27.
Training augments resistance exercise induced elevation of circulating brain derived neurotrophic factor (BDNF).
Yarrow JF, White LJ, McCoy SC, Borst SE.
3) Mediators Inflamm. 2010;2010:171023. Epub 2010 Dec 28.
Resistance exercise training-induced muscle hypertrophy was associated with reduction of inflammatory markers in elderly women.
Ogawa K, Sanada K, Machida S, Okutsu M, Suzuki K.
4) PLoS One. 2010 Aug 9;5(8):e12033.
Low-load high volume resistance exercise stimulates muscle protein synthesis more than high-load low volume resistance exercise in young men.
Burd NA, West DW, Staples AW, Atherton PJ, Baker JM, Moore DR, Holwerda AM, Parise G, Rennie MJ, Baker SK, Phillips SM.
5)Vahl N, Jorgensen JOL, Skjaerbaek C, Veldhuis JD, Orskow H, Christiansen JS 1997.
Abdominal adiposity rather than age and sex predicts mass and regularity of GH secretion in healthy adults. AM J Physiol, 272:E1108-E1116.
6) Weltman A., Pritzlaff C.J., Wideman L., Weltman J. Y., Blumer J.L., Abbott R.D., Hartman M.L., Veldhuis J.D. Exercise-dependent growth hormone release is linked to markers of heightened central adrenergic outflow. J Appl Physiol, Aug; 89(2):629-35, 2000.
7) Gordon S.E., Kraemer W.J., Vos N.H., Lynch J.M. and Knuttgen H.G.
Effect of acid-base balance on the growth hormone response to acute, high intensity cycle ergometer. J. Appl Physiol, 76:821-829, 1994.
8) J Clin Invest. 2004 January 1; 113(1): 25–27. The relative roles of growth hormone and IGF-1 in controlling insulin sensitivity
9) Hameed, M. et al. Expression of IGF-I splice variants in young and old human skeletal muscle after high resistance exercise. J Physiol. 2003 Feb 15;547(Pt 1):247-54. Epub 2002 Dec 20.
10) Mechanical load increases muscle IGF-I and androgen receptor mRNA concentrations in humans.
Marcas M. Bamman, James R. Shipp, Jie Jiang, Barbara A. Gower, Gary R. Hunter, Ashley Goodman, Charles L. McLafferty, Jr. and Randall J. Urban
Am J Physiol Endocrinol Metab 280:E383-E390, 2001. ;
11) American Journal of Physiology Endocrinology and Metabolism.
Leucine-enriched essential amino acid and carbohydrate ingestion following resistance exercise enhances mTOR signaling and protein synthesis in human muscle
Hans C. Dreyer, Micah J. Drummond, Bart Pennings, Satoshi Fujita, Erin L. Glynn, David L. Chinkes, Shaeen Dhanani, Elena Volpi, and Blake B. Rasmussen.
12) Eur J Appl Physiol (2005) 94: 505–513 DOI 10.1007/s00421-005-1380-x.
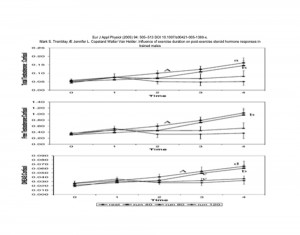
Mark S. Tremblay Æ Jennifer L. Copeland Walter Van Helder .Influence of exercise duration on post-exercise steroid hormone responses in trained males
13) The exercised skeletal muscle
European Journal Translational Myology – Myology Reviews 2010; 20 (3): 105-120
Marina Marini, Arsenio Veicsteinas
14) Am J Clin Nutr. 2000 Jul;72(1):106-11.
Maximizing postexercise muscle glycogen synthesis: carbohydrate supplementation and the application of amino acid or protein hydrolysate mixtures.
van Loon LJ, Saris WH, Kruijshoop M, Wagenmakers AJ.
15) Neuropharmacology. 2010 Sep-Oct;59(4-5):323-33. Epub 2010 Feb 16.
DHEA prevents Aβ25-35-impaired survival of newborn neurons in the dentate gyrus through a modulation of PI3K-Akt-mTOR signaling.
Li L, Xu B, Zhu Y, Chen L, Sokabe M, Chen L.
16) Nutr Neurosci. 2012 May; 15(3): 127–133. Natural mood foods: The actions of polyphenols against psychiatric and cognitive disorders
Fernando Gomez-Pinilla and Trang T J Nguyen
17) Horm Metab Res. 1999 Feb-Mar;31(2-3):114-9.
Insulin-like growth factors as mediators of functional plasticity in the adult brain.
Torres-Aleman I.
18) Journal of Sports Science and Medicine (2007) 6, 227-232
IGF-I and FGF-2 responses to Wingate anaerobic test in older men
19) FGF21 is an Akt-regulated myokine
Yasuhiro Izumiya, Holly A. Bina, Noriyuki Ouchi, Yuichi Akasaki, Alexei Kharitonenkov, Kenneth Walsh
20) Neuroscience. 1998 Dec;87(3):559-69.
Insulin-like growth factor-1 ameliorates age-related behavioral deficits.
Markowska AL, Mooney M, Sonntag WE.
21) J Neural Transm 2009 Aug;116(8):995-1005. Epub 2009 Mar 17.
The FGF-2/FGFRs neurotrophic system promotes neurogenesis in the adult brain.
Mudò G, Bonomo A, Di Liberto V, Frinchi M, Fuxe K, Belluardo N.
22) Dev Neurobiol. 2010 April; 70(5):339-349. Neurotrophic Factor Control of Adult SVZ Neurogenesis
Kevin G. Bath and Francis S. Lee
23) J Alzheimers Dis. 2012;28(1):11-24.
Stress-induced cytokines and neuronal dysfunction in Alzheimer’s disease.
Ricci S, Fuso A, Ippoliti F, Businaro R.
24) Pedersen, B.K. et al. Searching for the exercise factor: il IL-6 a candidate? J. Muscle Res. Cell Motil. 24, 113-119 (2003).
25) Hugen.F. et al. IL-7 is expressed and secreted by human skeletal muscle cells. Am. J. Physiol. Cell. Physiol. 298, C807-C816 (2010).
26) Lira, S.A. et al. Expression of the chemokine N51/KC in the thymus and epidermis of transgenic mice results in marked infiltration of a single class of inflammatory cells. J. Exp. Med. 180, 2039-2048 (1994).
27) Carbò, N. et. al. Interleukin-15 mediates reciprocal regulation of adipose and muscle mass: a potential role in bodyweight control. Biochim. Biophys. Acta 1526, 17-24 (2001).
28) Quinn, L.S., Strait-Bodey, L. Anderson, B.G., Argiles, J.M. & Havel, P.J. Interleukin-15 stimulates adiponectin secretion by 3T3-L1 adipocytes: evidence for a skeletal muscle-to-fat signaling pathway. Cell Biol. Int. 29,449-457 (2005).
29) Hamrick, M. W., McNeil, P. L. & Patterson, S. L. Role of muscle‐derived growth factors in bone formation. J. Musculoskelet. Neuronal Interact. 10, 64–70 (2010).
30) Metcalf, D. The unsolved enigmas of leukemia inhibitory factor. Stem Cells 21, 5–14 (2003).
31) Broholm, C. & Pedersen, B. K. Leukaemia inhibitory factor—an exercise‐induced myokine. Exerc. Immunol. Rev. 16, 77–85 (2010).
32) Broholm, C. et al. Exercise induces expression of leukaemia inhibitory factor in human skeletal muscle. J. Physiol. 586, 2195–2201 (2008).
33) Boström,P.etal.APGC1‐αdependentmyokine that drives brown‐fat‐like development of white fat and thermogenesis. Nature 481, 463–468 (2012).
34) Bente K. Pedersen and Mark A. Febbraio Reviews.Muscles, exercise and obesity: skeletal muscle as a secretory organ
35) Pedersen, B. K. Muscular IL‐6 and its role as an energy sensor. Med. Sci. Sports Exerc. 44, 392–396 (2012).
36) Hoene, M. & Weigert, C. The role of interleukin‐6 in insulin resistance, body fat distribution and energy balance. Obes. Rev. 9, 20–29 (2008).
37) Carey, A. L. et al. Interleukin‐6 increases insulin‐ stimulated glucose disposal in humans and glucose uptake and fatty acid oxidation in vitro via AMP‐activated protein kinase. Diabetes 55, 2688–2697 (2006).
38) Petersen, E. W. et al. Acute IL‐6 treatment increases fatty acid turnover in elderly humans in vivo and in tissue culture in vitro. Am. J. Physiol. 288, E155–E162 (2005).
39) van Hall, G. et al. Interleukin‐6 stimulates lipolysis and fat oxidation in humans. J. Clin. Endocrinol. Metab. 88, 3005–3010 (2003).
40) Kahn, B. B., Alquier, T., Carling, D. & Hardie, D. G. AMP‐activated protein kinase: ancient energy gauge provides clues to modern understanding of metabolism. Cell Metab. 1, 15–25 (2005).
41) Febbraio, M. A., Hiscock, N., Sacchetti, M., Fischer, C. P. & Pedersen, B. K. Interleukin‐6 is a
novel factor mediating glucose homeostasis during skeletal muscle contraction. Diabetes 53, 1643–1648 (2004).
42) Lyngsø, D., Simonsen, L. & Bulow, J. Interleukin‐6 production in human subcutaneous abdominal adipose tissue: the effect of exercise. J. Physiol. 543, 373–378 (2002).
43) Nielsen, S. & Pedersen, B. K. Skeletal muscle as an immunogenic organ. Curr. Opin. Pharmacol. 8, 346–351 (2008).
44) Petersen, A. M. & Pedersen, B. K. The anti‐ inflammatory effect of exercise. J. Appl. Physiol. 98, 1154–1162 (2005).
45) Steensberg, A., Fischer, C. P., Keller, C., Møller, K. & Pedersen, B. K. IL‐6 enhances plasma IL‐1ra, IL‐10, and cortisol in humans. Am. J. Physiol. Endocrinol. Metab. 285, E433–E437 (2003).
46) McPherron, A. C., Lawler, A. M. & Lee, S. J. Regulation of skeletal muscle mass in mice by a new TGF‐beta superfamily member. Nature 387, 83–90 (1997).
47) Rodgers, B. D. & Garikipati, D. K. Clinical, agricultural, and evolutionary biology of myostatin: a comparative review. Endocr. Rev. 29, 513–534 (2008).
48) Allen, D. L. et al. Myostatin, activin receptor IIb, and follistatin‐like‐3 gene expression are altered in adipose tissue and skeletal muscle of obese mice. Am. J. Physiol. Endocrinol. Metab. 294, E918–E927 (2008).
49) Zhao, B., Wall, R. J. & Yang, J. Transgenic expression of myostatin propeptide prevents diet‐induced obesity and insulin resistance. Biochem. Biophys. Res. Commun. 337, 248–255 (2005).
50) Lin, J. et al. Myostatin knockout in mice increases myogenesis and decreases adipogenesis. Biochem. Biophys. Res. Commun. 291, 701–706 (2002).
51) McPherron, A. C. & Lee, S. J. Suppression of body fat accumulation in myostatin‐deficient mice. J. Clin. Invest. 109, 595–601 (2002).
52) Allen, D. L., Hittel, D. S. & McPherron, A. C. Expression and function of myostatin in obesity, diabetes, and exercise adaptation. Med. Sci. Sports Exerc. 43, 1828–1835
(2011).
53) Hittel, D. S., Berggren, J. R., Shearer, J., Boyle, K. & Houmard, J. A.
Increased secretion and expression of myostatin in skeletal muscle from extremely obese women. Diabetes 58, 30–38 (2009).
54) Drummond MJ, Fujita S, Abe T, Dreyer HC, Volpi E, Rasmussen BB. Human muscle gene expression following resistance exercise and blood flow restriction. Med Sci Sports Exerc. 2008;40(4):691–8.
55) Roth SM, Martel GF, Ferrell RE, Metter EJ, Hurley BF,
Rogers MA. Myostatin gene expression is reduced in humans with heavy-resistance strength training: a brief communication. Exp Biol Med (Maywood). 2003;228(6):706–9.
56) Saremi A, Gharakhanloo R, Sharghi S, Gharaati MR, Larijani B, Omidfar K. Effects of oral creatine and resistance training on se- rum myostatin and GASP-1. Mol Cell Endocrinol. 2010;317(1–2): 25–30.
57) Walker KS, Kambadur R, Sharma M, Smith HK. Resistance training alters plasma myostatin but not IGF-1 in healthy men. Med Sci Sports Exerc. 2004;36(5):787–93.